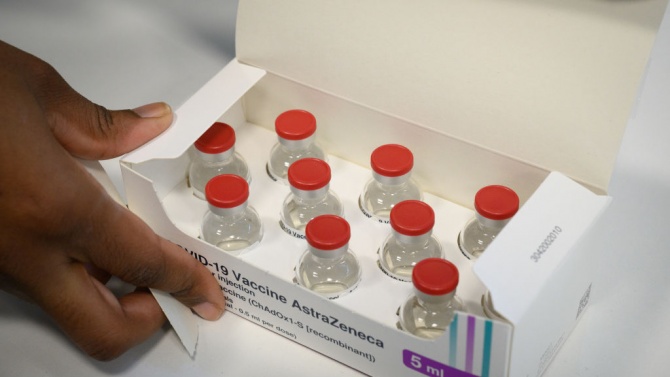
Ускоряват оценката на ваксината COVID-19 на AstraZeneca
Становище за разрешението за пускане на пазара на ваксината COVID-19 Vaccine AstraZeneca може да бъде издадено до 29 януари по време на заседанието на научния комитет на Европейската агенция по лекарствата (EMA) за хуманни лекарства, при условие, че предоставените данни за качеството, безопасността и ефикасността на ваксината са достатъчно надеждни и пълни и че цялата допълнителни информация, необходима за извършване на оценката, се предоставя незабавно.
Такъв кратък срок за оценка е възможен, защото експерти от EMA вече са прегледали някои данни за ваксината по време на непрекъснатия преглед - т.нар. rolling review. По време на тази фаза EMA вече е оценила данни от лабораторни проучвания (неклинични данни), данни за качеството на ваксината (за съставките и начина, по който е произведена) и някои доказателства за безопасността и ефикасността от обобщен анализ на междинните клинични данни от четири текущи клинични изпитвания в Обединеното кралство, Бразилия и Южна Африка. Допълнителна научна информация по въпроси, свързани с качеството, безопасността и ефикасността на ваксината, също е предоставена от компанията във връзка с искането на разрешение за условна употреба и в момента се оценява.
По време на прегледа на документите и на цялата пандемията EMA и нейните научни комитети се подпомагат от експерти от цялата европейска регулаторна мрежа за лекарства, за да се улеснят бързите и координирани регулаторни действия по отношение на лекарствата и ваксините срещу COVID-19.
Всичко по тематиката: Епидемията ковид (COVID-19) 18222 
Нов тест мери имунитета против SARS – COV-2 преди и след слагането на имунизацията 
102-годишна баба пребори COVID-19 в Турция 
Отпуснаха още 40 млн. лева за опазване на заетостта в секторите на туризма и превоза
Повече за Коронавирус
 най-ново: лесни стъпки: просто управление: eпидемия:
най-ново: лесни стъпки: просто управление: eпидемия:
Такъв кратък срок за оценка е възможен, защото експерти от EMA вече са прегледали някои данни за ваксината по време на непрекъснатия преглед - т.нар. rolling review. По време на тази фаза EMA вече е оценила данни от лабораторни проучвания (неклинични данни), данни за качеството на ваксината (за съставките и начина, по който е произведена) и някои доказателства за безопасността и ефикасността от обобщен анализ на междинните клинични данни от четири текущи клинични изпитвания в Обединеното кралство, Бразилия и Южна Африка. Допълнителна научна информация по въпроси, свързани с качеството, безопасността и ефикасността на ваксината, също е предоставена от компанията във връзка с искането на разрешение за условна употреба и в момента се оценява.
По време на прегледа на документите и на цялата пандемията EMA и нейните научни комитети се подпомагат от експерти от цялата европейска регулаторна мрежа за лекарства, за да се улеснят бързите и координирани регулаторни действия по отношение на лекарствата и ваксините срещу COVID-19.
Всичко по тематиката: Епидемията ковид (COVID-19) 18222



Отпуснаха още 40 млн. лева за опазване на заетостта в секторите на туризма и превоза
Повече за Коронавирус
 най-ново: лесни стъпки: просто управление: eпидемия:
най-ново: лесни стъпки: просто управление: eпидемия: Източник: novini.bg

КОМЕНТАРИ